2月10日,威尼斯欢乐娱人v3676基础医学院于晓教授团队、孙金鹏教授团队与四川大学华西医院邵振华教授团队、西安交通大学张磊教授团队和香港中文大学(深圳)杜洋教授团队通力合作,在Cell杂志在线发表了题为“Ligand recognition and allosteric regulation of DRD1-Gs signaling complexes”的最新研究成果,首次解析了多巴胺受体DRD1-Gs复合物结构,解释了DRD1配体识别、别构调节及与G蛋白偶联的分子机制。威尼斯欢乐娱人v3676基础医学院肖鹏研究员、硕士研究生钟亚妮、四川大学颜微副教授、西安交通大学博士研究生缑璐、国家蛋白质中心(上海)孔亮亮博士为本文共同第一作者;于晓教授、孙金鹏教授、邵振华教授、张磊教授、杜洋教授为共同通讯作者。

多巴胺(Dopamine)是一种能够给人带来愉悦感受的神经递质,也被称为快乐荷尔蒙(Feel good hormone),在中枢神经系统疾病治疗中具有重要作用。多巴胺通过多巴胺受体调节多种生理过程,例如奖赏、成瘾、记忆和认知、新陈代谢和激素分泌、控制运动等。多巴胺受体家族总共有五个成员,分为D1类(D1-like)受体和D2类(D2-like)受体两个亚家族,其中D1类受体(包括DRD1和DRD5)通过激活Gs/Golf和刺激环磷酸腺苷(cAMP)的产生,调节中枢神经系统奖赏、运动和认知,并在外周组织中发挥有益的作用,包括抑制炎症反应和维持心血管、肾脏的动态平衡。相比之下,D2类受体(包括DRD2、DRD3和DRD4)与Gi/Go偶联,抑制cAMP积累并调节不同的生理效应。五种多巴胺受体亚型之间具有很高的序列同源性、识别相同的内源性配体,针对这五种亚型的药物开发已取得重要进展,但是多巴胺受体亚型之间对激动剂识别、配体选择性、受体激活和G蛋白选择性的机制尚不清楚。
目前为止,D2类多巴胺受体识别拮抗剂配体的分子机制,选择性激动剂Bromocriptine激活DRD2-Gi信号转导复合物的分子机制相继被揭示。然而,D1类巴多按亚家族识别配体的结构基础仍然未知,发展高选择性激动剂药物是治疗帕金森病以及肾损伤高血压的临床需求。D1类多巴胺受体的激活态结构将为高亲和力和选择性激动剂的开发提供理论依据。
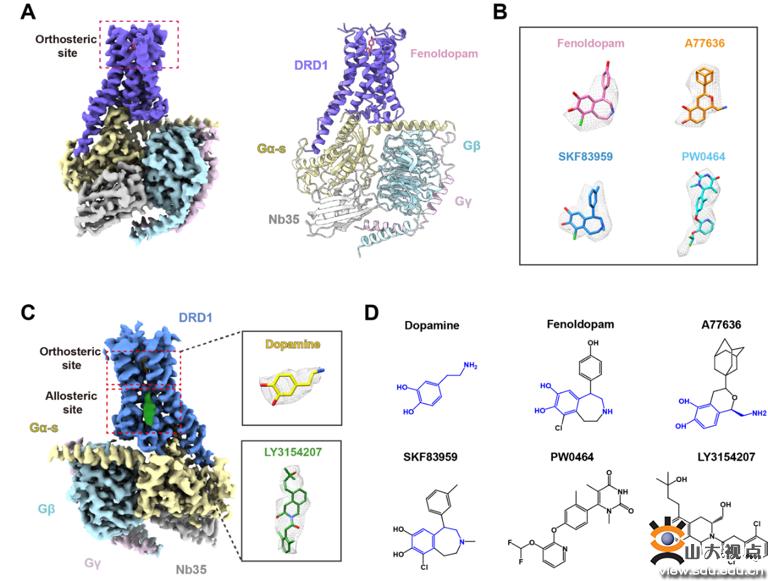
多巴胺受体DRD1-Gs复合物结构
该研究采用单颗粒冷冻电镜技术,首次解析了儿茶酚类激动剂(快乐荷尔蒙Dopamine、降血压临床用药Fenoldopam、完全激动剂A77636、G蛋白偏好性激动剂SKF83959),非儿茶酚类激动剂PW0464,以及正向别构调节剂LY3154207激活多巴胺受体DRD1与下游Gs三聚体形成复合体的三维结构(如图)。研究团队通过结构分析和生物化学等多种手段发现:(1)DRD1的正位结合口袋(orthosteric binding pocket,OBP)识别内源性荷尔蒙多巴胺及儿茶酚类激动剂配体的机制,首次揭示了多巴胺受体是如何结合并识别快乐荷尔蒙多巴胺的。DRD1受体的4个跨膜螺旋以及第二个胞外环(ECL2)组成了DRD1的OBP,D3.32-S5.42-S5.46是所有多巴胺受体识别含儿茶酚胺类激动剂的关键模体(motif),而S3.36-N6.55极性motif是D1类受体所特有的(对应D2类受体为C3.36-H6.55),该motif是多巴胺受体亚型和信号通路选择性的关键残基,这为亚型选择性配体药物的开发奠定了基础。(2)阐明了DRD1的非儿茶酚类激动剂PW0464的结合模式。PW0464除了与D3.32-S5.42-S5.46基序形成极性作用外,PW0464将吡啶头与苯氧基连接起来,与I1043.33、L190ECL2、F2886.51和F3137.35形成大量疏水相互作用。在TM2和ECL2区域,PW0464的嘧啶二酮基团与ECL2的D187-S189主链以及W993.28和V3177.39的侧链有广泛的接触,并与K812.61形成氢键。该结合模式不仅为选择性和偏向性药物的开发提供了理论基础,也为非儿茶酚类药物的继续开发奠定了基础。(3)揭示了DRD1延伸结合口袋(extended binding pocket, EBP)的特征,发现DRD1的EBP中保守的K2.61-W3.28-W7.43和N6.55-F7.35motif,是激动剂识别的重要结构特征。(4)发现了DRD1第二个胞内环(ICL2)、TM3和TM4形成的膜包埋的正向别构调节(positive allosteric modulator,PAM)位点,用于治疗痴呆症(Lewy body dementia)的LY3154207(礼来公司,临床二期)结合于该位点。(5)DRD1 TM5保守motif A5.65xxQ5.68-I5.69及FICL2是Gs偶联的关键决定因素,可能是D1类和D2类多巴胺受体对不同G蛋白的选择性的原因。
综上所述,该团队利用单颗粒冷冻电镜技术解析了多巴胺受体DRD1与G蛋白的复合物结构,从而在原子层面上详细阐释了DRD1的配体识别、别构调节及与G蛋白偶联的机制,该项研究将为高血压、帕金森综合症、肾损伤等疾病的药物开发和治疗带来新的曙光。
于晓研究团队长期关注代谢生理和病理生理中的GPCR,在过去的研究中阐明了胰岛中CRHR2和肾上腺素受体对胰岛环路和稳态的调控作用(J Clin Invest. 2017 Jun 30;127(7):2631)(Diabetologia. 2014 Sep;57(9):1899)(Diabetologia. 2015 Feb;58(2):324);揭示了CCK1R偏好性通路对胰岛功能的精确调控机制(Br J Pharmacol. 2015 Nov;172(21):5050);发现了粘附类受体对水盐代谢的调控(Elife. 2018 Feb 2;7:e33432.);阐明了胆汁酸受体配体识别及激活的独特机制(Nature.2020Nov;587(7834):499-504.)等,还在国内和基础医学院胡慧丽教授、孙金鹏教授一起首次实现胰岛的体外增殖(Cell Discovery 2020)。
以上研究得到了国家优秀青年科学基金、国家杰出青年科学基金和国家自然科学基金的资助与支持。
文章链接:
https://www.cell.com/cell/fulltext/S0092-8674(21)00071-4