12月1日,基础医学院易凡教授团队在国际代谢领域顶尖期刊Cell Metabolism 发表了题为 “Elevation of JAML promotes diabetic kidney disease by modulating podocyte lipid metabolism”的封面研究论文(中科院JCR期刊1区,五年IF:24.288)。当期配发了专题述评。威尼斯欢乐娱人v3676基础医学院博士生付艺和孙玉副教授为共同第一作者。易凡教授为通讯作者。威尼斯欢乐娱人v3676为该论文的第一单位。

在杂志封面图中,肾小球足细胞标记蛋白synaptopodin的免疫荧光染色(红色)图像很像肾脏中的一朵朵红花。有的枝繁叶茂,花朵也开的大而鲜艳,代表正常的肾小球;有的枝叶枯萎、花朵凋零,代表糖尿病条件下受损的肾小球。
足细胞是构成肾小球滤过屏障的关键部分,足细胞损伤是导致糖尿病肾病等肾小球疾病的重要原因。越来越多的研究表明,在高血糖之外还存在其他关键机制主导或协同参与了糖尿病肾病的进展。近期发现,脂代谢稳态失衡是导致糖尿病肾病发生发展的主要机制,特别是介导肾脏组织或者细胞区域内脂代谢稳态的调节机制越来越引起重视。
值得注意的是,肾脏实质细胞对脂质蓄积的敏感性不同,在糖尿病肾病中的作用也不同。研究表明,肾小管上皮细胞内脂质蓄积并不能诱导糖尿病肾病的发生。然而,足细胞对脂质蓄积异常敏感,足细胞内脂质的过度蓄积会引起足细胞功能紊乱导致细胞骨架重排、炎症反应等,最终引起足细胞死亡。而足细胞内脂质蓄积与循环中脂质含量并无直接关系,重要的是足细胞自身可表达多种脂质代谢相关基因,糖尿病可引起足细胞内脂代谢重编程,通过影响脂质的合成、摄取、分解、流出等过程直接调节足细胞区域内脂质代谢稳态,进而影响肾脏的功能。因此,深入探讨足细胞内脂质代谢稳态的调控机制、寻找有效的治疗靶点纠正脂质代谢失衡,减轻足细胞功能紊乱,对于防治糖尿病肾病具有重要的意义。
连接粘附分子(JAMs)属于免疫球蛋白超家族,包括JAM-A、JAM-B、JAM-C、JAM-4和JAML 5个成员,在调节细胞极性、上皮屏障功能和白细胞迁移等方面发挥重要作用。近年,JAMs家族成员在脂质代谢紊乱相关疾病中的作用已经引起了关注。研究发现,喂食高饱和脂肪、果糖和胆固醇饮食(HFCD)的JAM-A基因敲除小鼠患有更严重的非酒精脂肪性肝炎。JAML(连接粘附分子样蛋白)作为最晚被发现的新成员,除了介导免疫反应外,是否参与了脂质代谢稳态的调节,特别是肾脏区域内的脂质代谢调控尚不清楚。
在该项研究中,易凡教授团队首先发现,JAML在糖尿病肾病小鼠肾小球中表达显著升高;体外模拟糖尿病肾病条件刺激肾小球固有细胞,足细胞中JAML的表达水平呈特异性升高;更值得注意的是,在糖尿病肾病及其他伴有蛋白尿的慢性肾病如局灶性节段性肾小球硬化和膜性肾病患者的肾活检样本中,JAML的表达水平显著升高,并与血肌酐和脂质沉积呈正相关,与肾小球滤过率呈负相关。进一步利用足细胞特异性JAML基因敲除小鼠制备了两种经典的糖尿病肾病小鼠模型。特别是成功制备了足细胞特异性JAML基因敲除db/db小鼠,发现足细胞特异性敲除JAML可明显改善糖尿病肾病的肾损伤,减轻足细胞内的脂质蓄积。在机制上揭示了JAML通过调控SIRT1介导的表观遗传学信号通路,作用于脂肪酸及胆固醇合成的转录因子SREBP1及其下游靶基因,从而调控足细胞的脂质代谢。该研究首次发现JAML在糖尿病肾病等多种蛋白尿性肾病中通过调控足细胞内脂质代谢,在足细胞损伤的发生发展过程中发挥重要作用。这一发现为糖尿病肾病等蛋白尿性肾病的防治提供了新的研究思路和作用靶点。
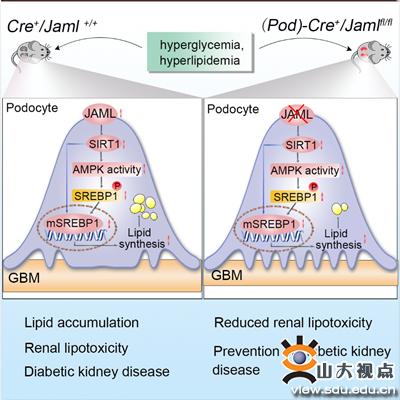
研究的模型示意图
易凡教授团队一直致力于糖尿病肾病等肾脏病发病机制的研究,重点聚焦于区域免疫调控、糖脂代谢稳态调控、表观遗传学调控以及免疫-代谢相互作用方面,以期寻找有效的新的药物靶点。本项研究得到了国家自然科学基金杰出青年基金、国家自然科学基金重点项目以及山东省自然科学基金重大基础研究等项目的资助。
原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(20)30552-0
专题述评链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(20)30597-0