近日,基础医学院赵伟教授团队在NLRP3炎症小体研究中取得进展,相关研究成果以“UAF1 deubiquitinase complexes facilitate NLRP3 inflammasome activation by promoting NLRP3 expression”(“UAF1去泛素化酶复合体通过增强NLRP3表达促进NLRP3炎症小体活化”)为题,在线发表于Nature Communications。威尼斯欢乐娱人v3676为独立第一单位和通讯作者单位。博士研究生宋慧和和助理研究员赵春媛为共同第一作者,赵伟教授为通讯作者。
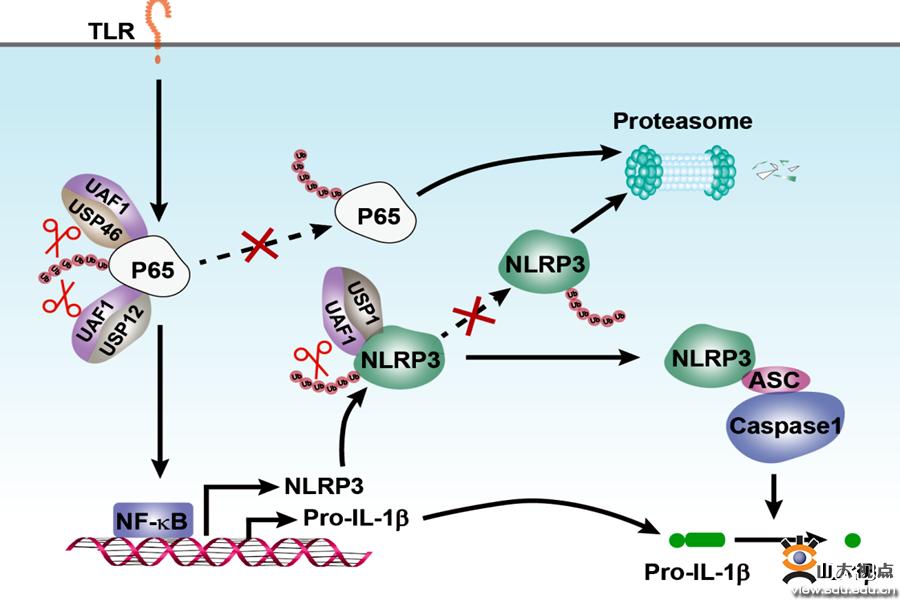
NLRP3炎症小体能够识别病毒、细菌等多种病原微生物及细胞内多种危险信号后活化,在抗感染、炎症等多种生理病理过程中具有重要作用。NLRP3炎症小体活化异常与多种疾病的发生、发展密切相关。多种病毒可通过调控NLRP3炎症小体活化,拮抗宿主的固有免疫反应;同时,NLRP3炎症小体过度活化在病毒感染导致的机体过度炎症反应(即细胞因子风暴)发生中具有重要作用。NLRP3蛋白表达水平被认为是炎症小体活化的关键限速步骤。因此,揭示NLRP3表达调控机制,对于阐明NLRP3炎症小体相关疾病发生、发展的机理,寻找免疫调节治疗的新途径具有重要意义。在此基础上,靶向NLRP3炎症小体活化和调控的不同环节,进行相关小分子化合物筛选和药物研发,将对NLRP3炎症小体活化失衡导致的多种疾病的防治提供更多、更理想的选择。该研究发现UAF1去泛素化酶复合体可特异性去除NLRP3 K48偶联的泛素化修饰、抑制其降解,稳定NLRP3表达,从而促进NLRP3炎症小体活化;同时还发现UAF1的特异性抑制剂ML323在体内体外均可抑制NLRP3炎症小体活化,为相关疾病提供了新的潜在治疗靶点。
赵伟教授团队长期从事病毒感染与天然免疫研究,揭示病毒感染过程中天然免疫的激活和调控机制;相关研究成果发表在Nat. Immunol.(2020)、Nat. Commun. (2020,2016,2014)、J.Exp.Med.(2017)、PNAS.(2016)、Cell.Rep.(2017)等杂志。上述研究得到了国家自然科学基金、英国医学科学院牛顿高级学者等项目的资助。
文章链接:https://www.nature.com/articles/s41467-020-19939-8