近日,基础医学院生物化学与分子生物学系孙金鹏教授课题组的研究成果“Arrestin biased AT1R agonism induces acute catecholamine secretion through TRPC3 coupling”(“血管紧张素受体可通过Arrestin与TRPC3通道发生偶联而促进肾上腺素的急性分泌”)在《自然通讯》(《Nature Communications》,09 February 2017. 影响因子11.329)上在线发表。该文章以威尼斯欢乐娱人v3676为独立通讯作者单位,孙金鹏教授为独立通讯作者,生理学系博士研究生刘春华和生物化学与分子生物学系博士研究生龚正为本文并列第一作者。该论文是孙金鹏教授近三年以来在膜受体的偏向性信号转导和磷酸化编码领域以通讯作者发表的第5篇高水平文章。
G蛋白偶联受体(GPCR)是非常重要的药物靶点,30%的临床处方药的直接靶点都是GPCR。正是因为GPCR在药物研究中的重要性,相关研究已经获得了10次诺贝尔奖。然而,GPCR信号转导的内在机制和作用模式还在逐步揭示的过程中。
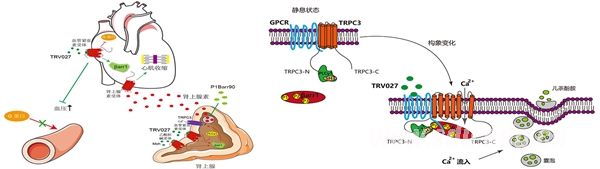
传统的观点认为,GPCR的信号转导包括两个时相,第一波信号由G蛋白介导,一般在细胞膜上而且发生比较快(2分钟以内),而第二波信号则由拘禁蛋白Arrestin介导,一般发生在内质网上,比较慢(5分钟以后)。孙金鹏教授课题组在对进入2期临床的药物TRV027的研究时发现,拘禁蛋白Arrestin可以在血管紧张素受体激活时直接偶联并激活TRPC3,来介导肾上腺素的急性分泌(1分钟以内)。这一研究发现打破了GPCR领域的固有认识,说明不仅G蛋白可以通过与通道偶联来介导GPCR的第一波信号,Arrestin也可以与离子通道发生偶联,并在细胞膜上介导快速的GPCR信号。进一步,课题组还发现血管紧张素受体下游的Arrestin蛋白亚型中β-arrestin-1的途径是不利的,而β-arrestin-2的信号途径是有益的。所以这一工作不仅揭示了GPCR新的工作模式,还说明发展血管紧张素受体下游β-arrestin-2亚型的偏向性配体有可能发展为更好的治疗心血管的药物。
孙金鹏,教授,博士生导师,齐鲁青年学者。孙金鹏教授长期从事GPCR方面的研究。近年来,在《Nature Communications》《PNAS》《Biol Psychiatry》《Cell Research》《Cell Reports》等SCI收录杂志发表50余篇文章,文章总引用次数1500余次。本项目受到了国家自然科学基金面上项目以及山东省杰出青年基金项目的支持。
文章链接:http://www.nature.com/articles/ncomms14335