近日,药学院赵保兵教授、沈月毛教授团队联合基础医学院李坚教授团队在Advanced Science杂志(中科院JCR期刊1区,五年IF=16.12)在线发表题为“Fine-tuning of cholesterol homeostasis controls erythroid differentiation”的研究论文,发现胆固醇异常导致贫血,揭示了胆固醇稳态调控红细胞发育的新分子机制。赵保兵教授、沈月毛教授和李坚教授为该论文共同通讯作者,药学院博士生卢志远和基础医学院硕士生黄丽霞为论文共同第一作者,威尼斯欢乐娱人v3676为第一单位和唯一通讯单位。

哺乳动物红细胞发育始于骨髓中的造血干细胞,在促红细胞生成素(EPO)作用下红系祖细胞依次分化为原红、早幼、中幼、晚幼红细胞,然后脱去高度固缩的细胞核分化为网织红细胞。网织红细胞通过自吞噬清除细胞器后完全成熟为红细胞(RBC)释放入血液中。红细胞发育异常导致多种疾病发生,包括地中海贫血、镰刀型红细胞贫血、戴-布二氏贫血(DBA)和红细胞增多症等。近年来多个信号通路和分子机制被发现参与红细胞发育调控,但目前仍存在许多未完全解决的难题,比如早期细胞经3-5次快速分裂增殖后如何脱离细胞周期,细胞核和染色质的高度固缩,以及末端脱核的分子机制等。
胆固醇是细胞膜的重要组成成分,在多种生理功能中发挥着重要作用。多项研究提示,胆固醇代谢与红细胞水平存在相关性。然而,胆固醇调控红细胞发育的分子机制尚不清楚。研究人员首先通过追踪体内和体外红细胞发育,发现红细胞发育成熟过程中细胞内胆固醇水平逐渐降低。发育早期的高水平胆固醇为细胞快速分裂增殖提供保障,随着关键转录因子GATA1表达上调,其结合并抑制SREBP2(胆固醇合成的关键转录因子),导致胆固醇生物合成下调,是导致细胞内胆固醇水平降低的主要原因。研究人员进一步通过RNA-seq发现,胆固醇水平的下调抑制mTORC1活性和核糖体生物合成,导致p53激活,从而促使细胞周期脱离。因此,发育后期低水平胆固醇可作为细胞增殖的制动器,促进红细胞从增殖向分化转换,这对于红细胞终末脱核至关重要。扰乱细胞内胆固醇稳态在体内和体外均损伤红细胞正常生成并导致贫血。同时,除了调控经典的胆固醇合成通路,团队首次发现SREBP2通过直接结合启动子区域调控GATA1辅因子NFE2的表达,形成一个负反馈通路来抑制珠蛋白的表达,保护晚期红细胞免受珠蛋白过度生成的毒性。
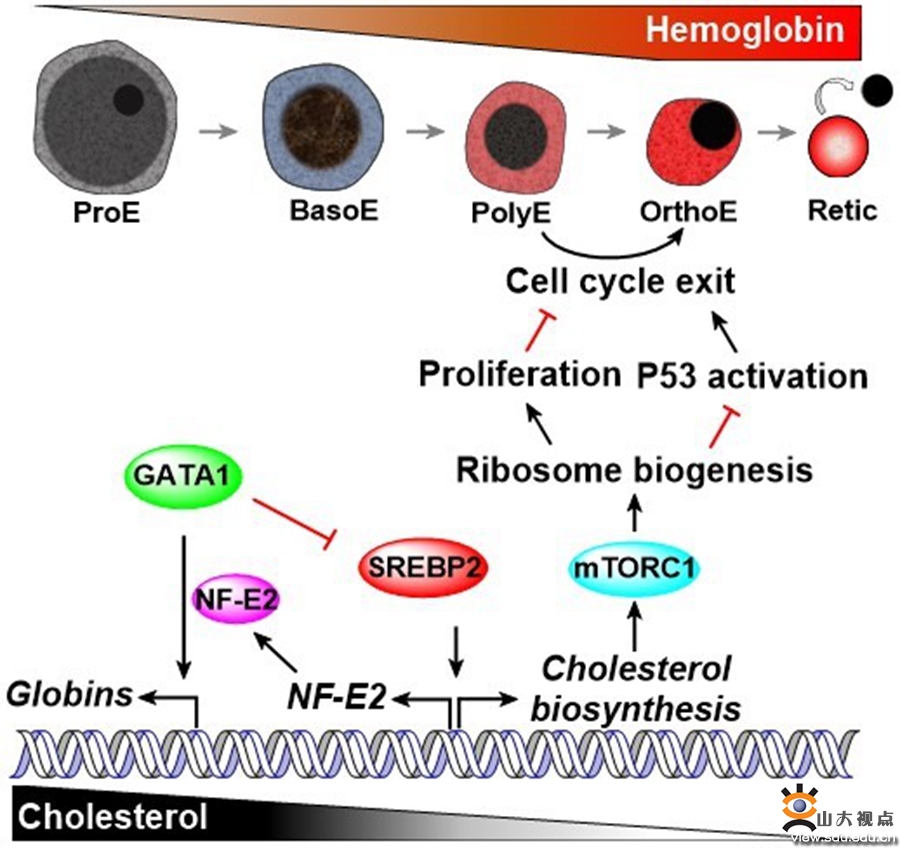
该工作通过体内和体外研究证实了GATA1通过SREBP2调控胆固醇水平以及红细胞发育关键基因NFE2表达水平影响红细胞发育,揭示了GATA1调控胆固醇稳态介导红细胞发育的新分子机制,为红细胞发育相关疾病的诊治提供了新线索,也为发展体外造血提供了重要理论依据。上述研究得到了国家自然科学基金面上项目、山东省泰山学者、威尼斯欢乐娱人v3676齐鲁青年学者和青年交叉创新团队项目资助。
威尼斯欢乐娱人v3676赵保兵教授团队主要从事血液系统发育的分子机制和血液疾病的致病机理研究,包括红系细胞发育、造血干细胞自我更新及相关血液疾病的分子调控机制,发掘潜在药物靶标,并开展靶向小分子先导化合物筛选研究。迄今在J Clin Invest、Dev Cell、Blood、Leukemia和Haematologica等期刊发表SCI论文30余篇。
原文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/advs.202102669