近日,基础医学院孙金鹏、于晓教授团队在孕酮膜受体领域取得新进展。相关研究成果以“Progesterone activates GPR126 to promote breast cancer development via the Gi pathway”为题,发表在美国国家科学院院刊PNAS杂志(中科院JCR期刊一区,5年IF = 12.291)上。本课题由基础医学院孙金鹏教授和于晓教授团队联合完成,孙金鹏教授,于晓教授,学院张鹏举教授和肖鹏教授为共同通讯作者,基础医学院博士后安文涛,博士研究生林慧、马丽娟为共同第一作者。
类固醇激素孕酮(progesterone)除了通过核受体PR发挥经典的基因组作用之外,还存在快速的非基因组作用方式,但是介导其快速作用的受体及具体分子机制尚未完全阐明,目前尚未发现介导孕酮快速作用的GPCR受体。
孙金鹏教授、于晓教授和学院易凡教授团队联合中科院上海药物所徐华强教授和浙江大学张岩教授在前期的研究发现了糖皮质激素可以通过黏附类GPCR-GPR97发挥快速作用,并解析了糖皮质激素-GPR97复合物的冷冻电镜结构(Nature, 2021, 589: 620-626,高被引论文),解开了几十年来学界中糖皮质激素快速作用的机制之谜。
GPR126与GPR97同属于黏附类受体ADGRG家族,在周围神经系统、骨骼和胚胎发育等方面有着重要作用,通过筛选34种类固醇激素,研究人员发现孕酮和17-羟基孕酮能够特异性的激活GPR126并引起下游Gi信号通路的活化。孕酮是GPR126特异的Gi偏好性配体,而17-羟基孕酮除了激活Gi信号通路之外,还在高浓度时激活Gs信号通路。
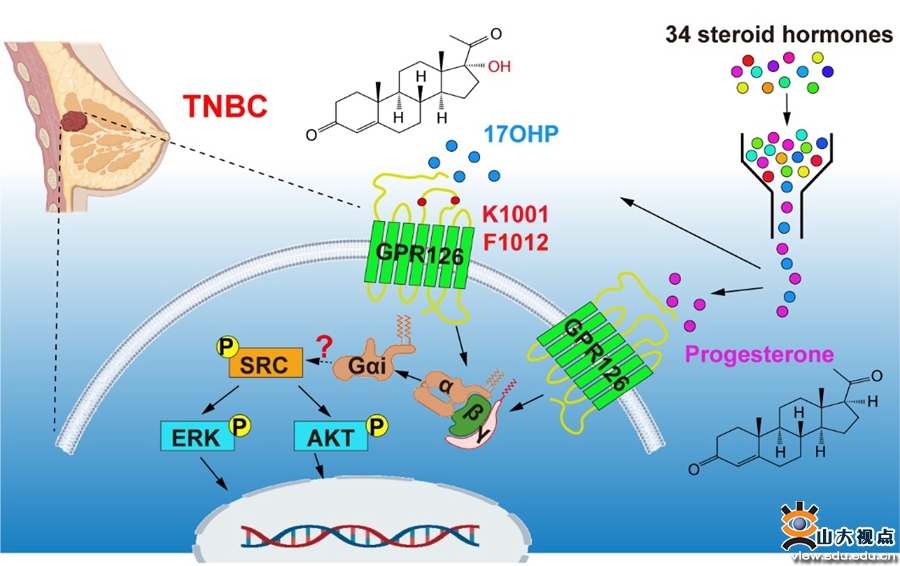
图1孕酮通过GPR126促进了乳腺癌的发展
研究团队进一步模拟了孕酮和17-羟基孕酮激活GPR126的结构特征,找到了GPR126结合口袋中与孕酮和17-羟基孕酮作用的关键氨基酸位点,进一步功能实验发现,孕酮和17-羟基孕酮通过激活GPR126-Gi信号通路促进了下游信号分子SRC、ERK和AKT的磷酸化,进一步促进了三阴性乳腺癌细胞的增殖和体内成瘤(图1)。
本文的课题开展,思路凝练和文章写作方面,以及相关的课题开展方面得到了威尼斯欢乐娱人v3676第二医院王传新院长和杜鲁涛教授,以及齐鲁医院冯世庆教授的关键指导。
于晓教授课题组长期聚焦于胰岛稳态的作用及调节机制,阐明了跨膜信号转导对胰岛β细胞分泌功能及胰岛稳态的精确调控机制,包括GPCR下游偏好性信号途径和第二信使的信号时序等(Cell Metabolism 2022,Nature 2020,EMBO Reports 2021,eLife 2018,Nature Commun 2021);揭示了胰岛中δ-β细胞环路在胰岛稳态维持中的重要作用(J Clin Invest. 2017,Cell Discov. 2020,Cell Death Dis. 2018);开发了选择性调节G蛋白偶联受体和PEST磷酸酶亚家族活力来对胰岛稳态失衡发展新的干预策略(Cell 2021,PNAS 2021,Cell Research 2014,Cell Reports 2016)等。
孙金鹏教授课题组长期从事膜受体G蛋白偶联受体(GPCR)的相关研究,聚焦于GPCR功能多样性的细胞机制以及针对GPCR的药物发展,发现了GPR97是糖皮质激素的膜受体,首次发现血管紧张素受体的内源性别构调节因子COMP及高同半胱氨酸可以直接激活AT1R等(Nature 2021,Cell Research 2021,Nature Commun 2017,2021);创新性地提出了GPCR磷酸化编码的“笛子模型”(Nature Commun 2015,2021, PNAS 2021),多聚脯氨酸码头分选及别构建调控理论(Nature Chem Biol 2018);阐明了多个GPCR对胰岛功能,糖代谢和体外组织再造的调控作用,为进一步靶向GPCR偏向性信号途径的药物设计提供了指导(Biol Psychiatry 2017, Diabetologia 2014,Br J Pharmacol 2015);阐明了快乐激素多巴胺受体以及肝肠轴枢纽胆汁酸受体识别其内源性配体,及偏好性信号转导的结构基础以及痒觉感知的分子机制(Nature 2020,2021,Cell 2021)等。
文章链接:https://doi.org/10.1073/pnas.2117004119