近日,药学院张娜、刘永军团队在重塑肿瘤—淋巴结免疫微环境提高肿瘤治疗效果方面取得新进展,并在国际期刊Nature Communications杂志上发表了题为“Temperature Sensitive Liposome Based Cancer Nanomedicine Enables Tumour Lymph Node Immune Microenvironment Remodeling”的研究性论文(中科院一区TOP),张娜教授和刘永军副教授为通讯作者,博士研究生付顺利为第一作者,药学院为第一作者单位和唯一通讯作者单位。
逆转肿瘤免疫抑制微环境策略已经被广泛用于增强肿瘤免疫治疗效果,肿瘤—淋巴结免疫微环境也受到越来越多的关注。肿瘤引流淋巴结作为肿瘤相关免疫细胞的“大本营”,其微环境能够显著影响免疫细胞的存活和功能,进而影响肿瘤免疫治疗效果。然而,目前尚缺乏逆转肿瘤引流淋巴结免疫抑制微环境的有效手段,迫切需要开发一种能够同时调控肿瘤—淋巴结免疫微环境的新型递药系统,以增强肿瘤免疫治疗效果。
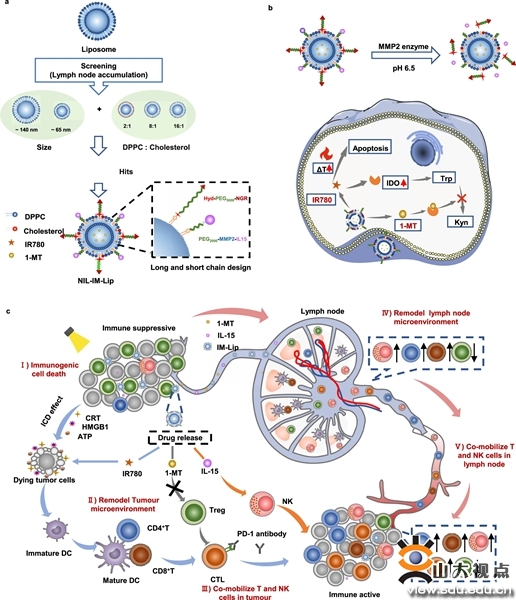
图1.纳米诱导剂重塑肿瘤—淋巴结免疫微环境,同时激活T细胞和NK细胞,有效提升肿瘤免疫治疗效果示意图
该论文设计了一种新型的pH/基质金属蛋白酶2(MMP2)/温度三敏感免疫调节纳米诱导剂(NIL-IM-Lip),将光热诱导剂IR780和IDO1抑制剂1-MT共同装载于温敏脂质体内部,在脂质体表面利用pH敏感的DSPE-Hyd-PEG修饰NGR靶头,MMP2敏感的DSPE-PEG-MMP2肽连接IL-15。首先,通过筛选纳米诱导剂的粒径及其胆固醇组份比例,以期获得最优肿瘤和淋巴结靶向的NIL-IM-Lip。研究结果显示,相较于大粒径脂质体而言,小粒径脂质体能够实现更多的淋巴结蓄积。此外,胆固醇组分比例也是影响脂质体淋巴结蓄积的重要因素,研究结果显示,DPPC:胆固醇在8:1时,脂质体表现出更优的淋巴结蓄积能力。因此,制备适宜粒径及胆固醇比例的脂质体能够实现肿瘤和淋巴结的高效蓄积。
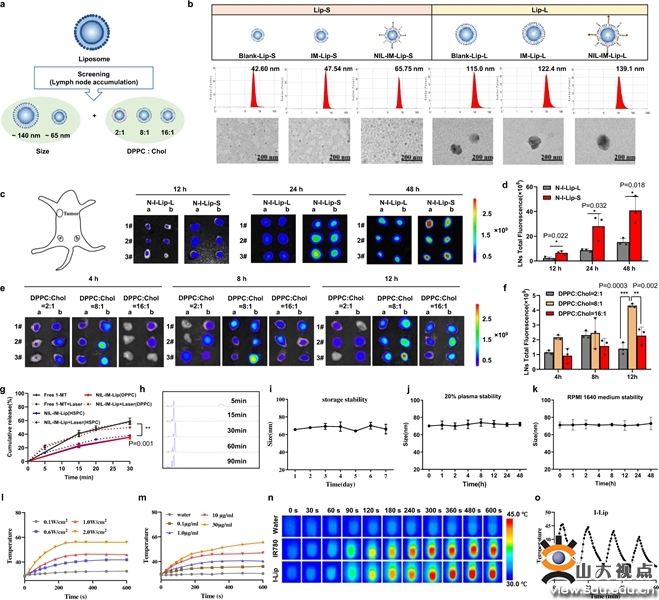
图2.粒径和胆固醇组分比例影响脂质体的体内分布及其在肿瘤组织和淋巴结的蓄积
NIL-IM-Lip在NGR介导下精确递送到肿瘤组织,在肿瘤微酸性和富含MMP2的微环境中NGR靶头脱落并释放IL-15,随后,在肿瘤组织内部高间质压力条件下IM-Lip和IL-15被递送到肿瘤引流淋巴结。研究结果显示,NGR的修饰能够显著增强脂质体在肿瘤组织和淋巴结内蓄积;MMP2敏感肽修饰的IL-15能够显著增强其在淋巴结的蓄积。证明pH/MMP2/温度三敏感的设计能够充分促进NIL-IM-Lip的肿瘤和淋巴结的同时蓄积。
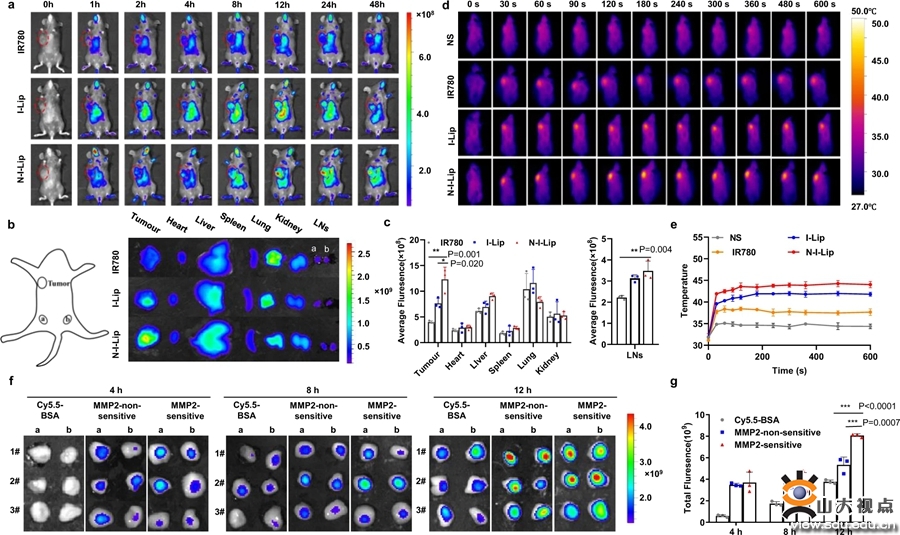
图3. NIL-IM-Lip显著增强IM-Lip肿瘤和淋巴结分布,有效增加IL-15的淋巴结蓄积
在实现高效的肿瘤和淋巴结蓄积后,NIL-IM-Lip通过1-MT解除肿瘤和淋巴结内Treg的免疫抑制作用;局部光热处理能够诱导肿瘤细胞的免疫原性死亡,促进肿瘤抗原递呈,启动基于T细胞的免疫反应;IL-15可以进一步激活肿瘤和淋巴结内的T细胞和NK细胞,从而重塑了肿瘤—淋巴结免疫微环境,有利于肿瘤免疫治疗。研究结果表明,NIL-IM-Lip联合PD-1抗体在热肿瘤(B16F10模型)和冷肿瘤(CT26模型)中均显示了良好的抗肿瘤效果。该论文的研究结果凸显了肿瘤—淋巴结免疫微环境调控在肿瘤免疫治疗中的关键作用,论文制备的纳米诱导剂和免疫检查点抑制剂联用在模型动物上获得满意治疗效果,展现出了广阔的临床应用前景。
近年来,张娜、刘永军团队在肿瘤免疫联合治疗方向取得了一系列研究成果,先后开发了化疗-光热治疗集成纳米递送平台(Adv. Funct. Mater. 2021, 2100437),集成纳米航空母舰(Adv. Funct. Mater. 2021, 31, 2106123),重塑肿瘤免疫微环境的纳米笼(ACS Nano 2022, 16, 3, 4263–4277),双转换原位自组装疫苗(Chemical Engineering Journal 2023,454,140190),按需集成纳米接合器(Acta Pharmaceutica Sinica B 2023,13,4,1740-1754),基于启动反应—促进活性—缓解抑制的自体肿瘤疫苗(Biomaterials 2023,297,122104)等新型药物递送系统。上述研究工作得到了国家自然科学基金,山东省重点研发项目和威尼斯欢乐娱人v3676青年学者未来计划项目的大力支持。
论文链接:https://www.nature.com/articles/s41467-023-38014-6