近日,基础医学院赵伟教授团队在NLRP3炎症小体研究中取得新进展,并在Journal of Clinical Investigation(IF=16.7)杂志上发表题为“Posttranslational ISGylation of NLRP3 by HERCs enzymes facilitates inflammasome activation in models of inflammation”的研究成果,基础医学院博士后秦颖为本文第一作者,赵伟教授为本文通讯作者。威尼斯欢乐娱人v3676为本论文的第一和独立通讯作者单位。
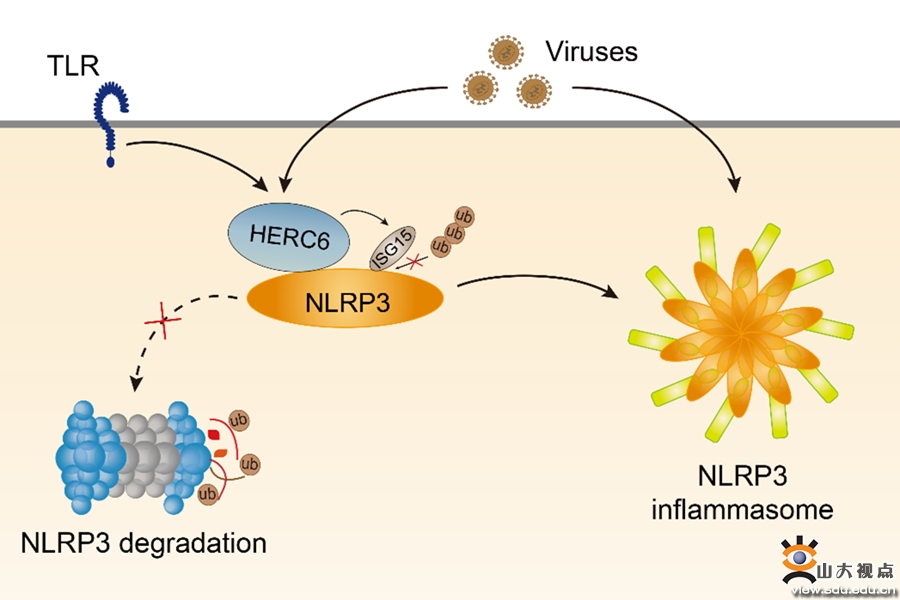
HERC6促进NLRP3炎症小体活化的模式图
NLRP3在感知来自微生物的病原体相关分子模式(PAMPs)和宿主来源的损伤相关分子模式(DAMPs)后形成炎症小体,诱导细胞因子IL-1β和IL-18的成熟和分泌,并引起细胞焦亡,启动炎症反应。NLRP3炎症小体是先天免疫系统启动炎症反应的重要组成部分,其最佳激活有利于宿主高效快速地消灭入侵的病原体。然而,异常的NLRP3炎性小体激活与多种炎症相关疾病有关,如糖尿病、动脉粥样硬化、肥胖、癌症和阿尔茨海默病等。NLRP3的蛋白质翻译后修饰(PTMs),包括泛素化和磷酸化等,可以调控炎症小体的活化并决定炎症反应的强度。然而,其他PTMs在控制NLRP3炎症小体活化中的作用尚不清楚。该研究发现Toll样受体启动诱导NLRP3的ISG化(一种ISG15与靶蛋白共价结合的PTM)以稳定NLRP3蛋白水平。以SARS-COV-2感染为代表的病毒感染和I型干扰素(IFNs)诱导ISG15和主要的E3 ISG化连接酶HERCs(人中为HERC5,小鼠中为HERC6)的表达。HERCs增强NLRP3 ISG化,抑制K48位偶联的多聚泛素化和泛素蛋白酶体途径的降解,从而增强NLRP3炎症小体活化。除此之外,Herc6基因敲除可改善小鼠体内NLRP3依赖性炎症和病毒感染引起的炎症反应的过度活化。这些结果阐明了I型IFNs反应调控炎症小体活化和病毒感染诱导的NLRP3异常活化的机制。该工作发现ISG化是NLRP3的一个新的PTM,并为调节NLRP3依赖的免疫疾病提供了一个治疗靶点。
赵伟教授团队主要从事病毒感染与固有免疫研究,聚焦病毒感染与机体防御相互作用,揭示病毒免疫逃逸机制和机体炎症风暴的发生机理,为病毒性疾病防治提供理论依据。相关研究成果发表在Nature Immunology、Immunity、Journal of Experimental Medicine、Journal of Clinical Investigation、Nature Communications、Science Advances、PNAS等杂志。上述研究得到了国家自然科学基金、英国医学科学院牛顿高级学者、威尼斯欢乐娱人v3676攀登计划创新群体项目等项目的资助。
文章链接:https://www.jci.org/articles/view/161935