近日,基础医学院赵伟教授团队在Nature Communications在线发表以“S-nitrosothiol homeostasis maintained by ADH5 facilitates STING-dependent host defense against pathogens”为标题的研究成果。基础医学院研究员贾木天、博士研究生柴莉为论文共同第一作者,赵伟教授为本文通讯作者,威尼斯欢乐娱人v3676为第一作者和通讯作者单位。
病原与免疫系统之间的相互作用,是决定病原感染结局的关键。巨噬细胞等免疫细胞感知病原感染后,通过氧化爆发产生活性氮(RNS)等物质以抵御病原感染;同时,病原感染诱导产生的过量RNS通过S-亚硝基硫醇(SNO)积累破坏生物大分子的功能,影响宿主正常生理功能。然而,病原感染是否通过破坏SNO稳态影响固有免疫活化、感染时机体固有免疫如何能够正常启动,均远未阐明。
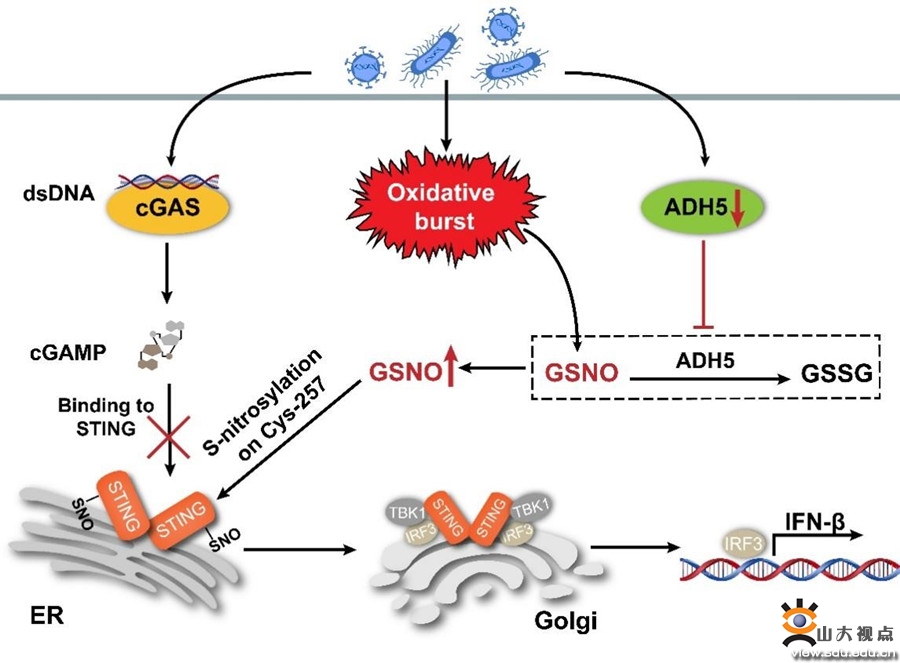
该研究发现,S-亚硝基谷胱甘肽(GSNO)作为细胞主要的内源性SNO,抑制HSV-1和李斯特菌感染诱发的固有免疫反应。cGAS-STING介导的DNA识别通路,在抗感染免疫启动中发挥关键作用。机制研究发现,GSNO诱导STING第257位半胱氨酸发生S-亚硝基化修饰,进而破坏其配体结合口袋的结构,抑制其与第二信使cGAMP结合。GSNO还原酶(GSNOR,由ADH5基因编码)是分解GSNO并降低细胞内SNO含量的关键分子。病原感染导致ADH5启动子区域发生DNA甲基化修饰,通过抑制ADH5表达导致细胞内SNO的过量积累,促进STING的S-亚硝基化修饰并抑制其激活。ADH5缺失抑制STING介导的固有免疫反应。因此,病原感染通过下调宿主细胞ADH5表达、导致细胞内RNS生成及积累,进而抑制STING介导的固有免疫反应。该研究揭示了病原如何通过破坏宿主细胞SNO稳态抑制宿主固有免疫,从而实现免疫逃逸和持续性感染的机制;阐释了ADH5维持的SNO稳态在STING介导的固有免疫启动中的重要作用,为STING活化异常相关疾病的治疗提供了新的靶点。
赵伟教授团队主要从事病毒感染与固有免疫研究,聚焦病毒感染与机体防御相互作用,揭示病毒免疫逃逸机制和机体炎症风暴的发生机理,为病毒性疾病防治提供理论依据;相关研究成果发表在Nature Immunology、Immunity、Journal of Experimental Medicine、Journal of Clinical Investigation、Nature Communications、Science Advances和PNAS等杂志。上述研究得到了国家自然科学基金、威尼斯欢乐娱人v3676攀登计划创新群体项目等项目的资助。