近日,威尼斯欢乐娱人v3676齐鲁医院超声科李杰教授团队在Journal of Nanobiotechnology(中科院1区,五年平均IF=11.5)发表题为“Hydralazine loaded nanodroplets combined with ultrasound-targeted microbubble destruction to induce pyroptosis for tumor treatment”的研究论文,报道了超声靶向微泡破坏技术(UTMD)联合纳米超声造影剂在诱导细胞焦亡用于GSDME沉默肿瘤治疗中的应用。该研究构建了肿瘤微环境及超声靶向微泡破坏技术控释纳米体系,同时负载DNA去甲基化药物,并将其靶向递送至肿瘤部位,实现综合诊断和可视化治疗模式,合理调控肿瘤细胞焦亡过程,为优化GSDME基因沉默型实体肿瘤的治疗提供了新策略。李杰教授为该论文的通讯作者,硕士研究生黄淑婷为该论文的第一作者,威尼斯欢乐娱人v3676齐鲁医院为该论文的第一作者和通讯作者单位。

细胞焦亡是程序性细胞死亡的一种新形式,其发生依赖于caspase切割GSDM蛋白家族成员,为肿瘤的治疗提供了一种切实可行的治疗策略。然而,由于启动子的高甲基化,大多数癌细胞缺乏关键蛋白GSDME,而无法启动细胞焦亡过程,导致治疗效果不理想。由此,通过上调肿瘤细胞中GSDME的表达来特异性地诱导细胞焦亡可能是一种有前景的抗肿瘤策略。此外,传统的细胞焦亡试剂具有清除快、全身性副作用和肿瘤部位低浓度等特点,限制了其在临床肿瘤治疗中的应用。因此,迫切需要找到一种新的、协同的方法,来最大限度地发挥诱导焦亡,达到肿瘤治疗的效果。
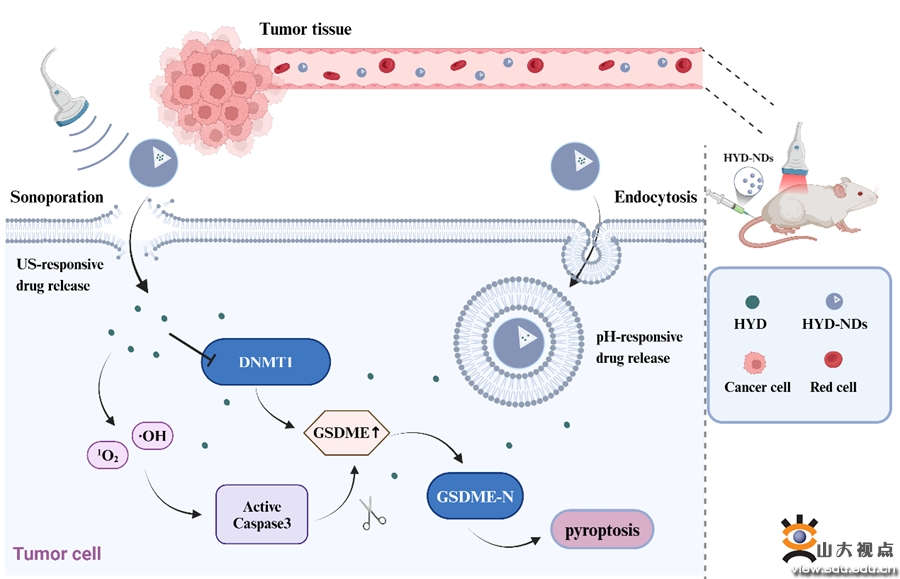
本研究构建了具有pH和超声双重响应性的纳米靶向给药系统(HYD-NDs)与UTMD联合作用,在治疗实体瘤的同时最大限度地降低全身毒性。由于其对肿瘤微环境酸性敏感,HYD-NDs可以在肿瘤部位特异性积聚。对肿瘤部位进行低剂量超声辐照,引起HYD释放和ROS产生,前者可上调GSDME的表达,后者激活caspase-3,而GSDME是ROS介导的caspase-3裂解的特异性焦亡底物,两者共同作用导致肿瘤细胞焦亡。HYD-NDs可作为诱导细胞焦亡的良好生物相容性平台,它与UTMD的协同作用为优化GSDME沉默实体瘤的治疗提供了一种新策略。
李杰教授团队长期致力于构建精准医疗下靶向性纳米超声造影剂的肿瘤诊疗一体化系统,对纳米级超声造影剂的优化制备、可视化精准诊疗、肿瘤部位的超声造影成像等进行了深入的基础和临床研究。近年来,课题组在肿瘤精准分子影像、肿瘤可视化治疗及疗效评估方面取得了一系列创新性成果,先后发表于Advanced Science、Journal of Controlled Release、Journal of Nanobiotechnology等学术期刊,授权相关国家发明专利近10项,相关研究成果多次在国内外超声医学大会上报告,产生了广泛影响。该系列研究获得了国家自然科学基金面上项目和山东省泰山学者计划的资助。