近日,基础医学院高成江教授团队在抗真菌免疫调控研究中取得新进展,在Signal Transduction and Targeted Therapy杂志(中科院一区,IF:18.187)以Article形式发表题为“TRIM31 facilitates K27-linked polyubiquitination of SYK to regulate antifungal immunity”的研究论文。威尼斯欢乐娱人v3676基础医学院博士研究生王雪儿、威尼斯欢乐娱人v3676基础医学院博士研究生张洪海为本论文的共同第一作者,高成江教授为该论文的通讯作者。威尼斯欢乐娱人v3676为第一作者单位和唯一通讯作者单位。
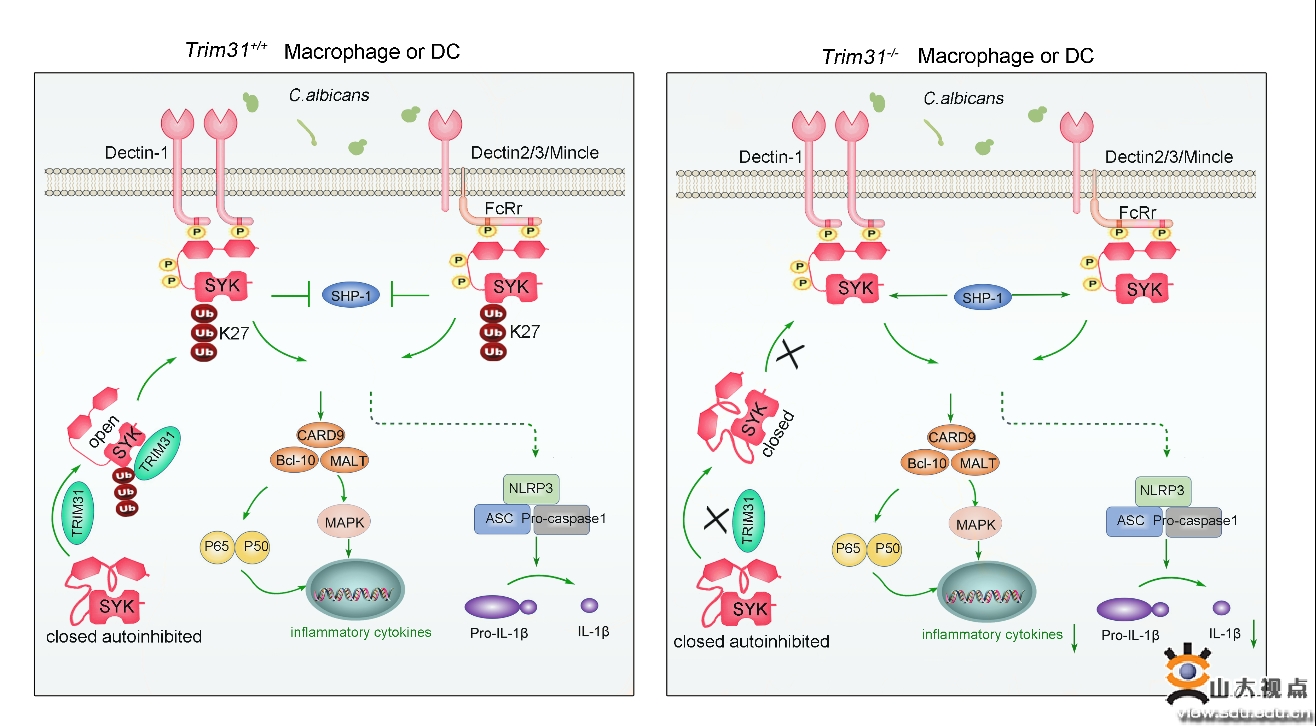
侵袭性真菌感染严重危害人类健康。当机体受到真菌感染,C型凝集素受体(C-type lectin receptor,CLR)可识别真菌的细胞壁成分,进而招募并活化脾酪氨酸激酶SYK,随后激活下游激酶PLC和PKC-δ,促进CARD9磷酸化,并与BCL10和MALT1形成CARD9-BCL10-MALT1(CBM)复合体,激活经典的NF-κB和MAPK信号通路,活化抗真菌天然免疫信号通路,发挥抗真菌免疫功能。
近年来蛋白质泛素化修饰在抗真菌天然免疫信号转导中的调控功能越来越受到重视。高成江教授团队通过筛选靶向SYK的E3泛素连接酶,发现TRIM31依赖其E3泛素连接酶活性对SYK第375和517位赖氨酸进行K27位泛素化修饰,促进其由细胞质转位到细胞膜,并与Dectin-1或接头分子FCRγ结合,同时抑制磷酸酶SHP1对其去磷酸化,最终增强SYK的激酶活性;TRIM31敲除可降低SYK介导的抗真菌天然免疫信号传导,Trim31敲除小鼠更易受到白色念珠菌的感染。
高成江教授团队通过筛选靶向CARD9的去泛素化酶,发现OTUD1依赖其去泛素化酶活性切除CARD9上K33位连接的多聚泛素链,促进CBM复合体的组装,从而增强了下游NF-κB和MAPK信号通路的活化;OTUD1缺失可降低CARD9介导的信号传导,促炎细胞因子和趋化因子的表达降低,Otud1敲除小鼠对白色念珠菌的感染更易感(J Immunol2021; 206:1832-1843)。以上研究结果丰富了抗真菌天然免疫信号转导的研究,为抗真菌临床研究和药物研发提供了新的理论依据。
高成江教授团队长期致力于天然免疫信号转导的调控机制研究,研究成果发表在Nature Immunology,Signal Transduction and Targeted Therapy,Advanced Science,Journal of Experimental Medicine,Nature Communications,Cell Death & Differentiation,PLOS Pathogens等国际权威杂志上。上述研究得到威尼斯欢乐娱人v3676攀登计划创新群体项目、国家自然科学基金重点项目等项目资助。
文章链接:https://doi.org/10.1038/s41392-021-00711-3