近日,威尼斯欢乐娱人v3676基础医学院于晓教授、孙金鹏教授研究团队以及徐云飞研究团队联合攻关,在磷酸酶调控肾上腺分泌领域取得新进展。相关研究成果以“PTP-MEG2 regulates quantal size and fusion pore opening through two distinct structural bases and substrates”为题,在欧洲分子生物学学会会刊EMBO Reports(中科院JCR期刊一区,5年IF= 9.214)在线发表。威尼斯欢乐娱人v3676徐云飞副教授、威尼斯欢乐娱人v3676基础医学院博士研究生陈旭为该文章共同第一作者,威尼斯欢乐娱人v3676于晓教授、孙金鹏教授、崔敏副教授和徐云飞副教授为论文共同通讯作者,威尼斯欢乐娱人v3676为第一作者单位。
囊泡的胞吐作用的分泌是几乎所有生理过程都涉及的基本生物学过程。分泌囊泡的内容物包括神经递质、免疫因子和激素等。关于细胞囊泡运输与调节机制的研究曾获2013年的诺贝尔生理学奖,但目前磷酸化调控在囊泡分泌过程中扮演何种角色尚不完全清楚。磷酸化主要包括两种,即丝氨酸/苏氨酸磷酸化和酪氨酸磷酸化,由激酶和磷酸酶协同调控。在胞吐过程中,丝氨酸/苏氨酸磷酸化参与囊泡分泌的过程已被部分证明,但酪氨酸磷酸化在囊泡分泌过程中的精确作用,以及哪些酪氨酸磷酸酶参与了囊泡分泌的调节仍知之甚少。
于晓、孙金鹏教授团队首次证明酪氨酸磷酸酶PTP-MEG2通过去磷酸化不同蛋白底物,精确调控肾上腺嗜铬细胞分泌儿茶酚胺的两个重要步骤,即囊泡融合过程以及膜上融合孔形成和解离的过程。PTP-MEG2可以通过去磷酸化NSF调控囊泡的融合过程。同时,应用蛋白质组学技术,生物信息学预测和细胞及电化学检测技术,研究团队发现PTP-MEG2还可以通过去磷酸化MUNC18-1和DYNAMIN2调控膜上融合孔的形成和解离过程。团队进一步通过生化和晶体学分析解释了PTP-MEG2催化不同底物的关键位点和结构基础,意外的发现PTP-MEG2可以通过不同的结构基础来调控以上两个过程(下图)。因此,可以根据这些结构基础和关键位点设计PTP-MEG2调控不同分泌过程的特异性抑制剂。本研究是第一次系统阐述PTP-MEG2在嗜铬细胞分泌中的生理作用和分子机制,发现了酪氨酸磷酸化在囊泡分泌中的关键调节作用和精确机制,阐明了动态酪氨酸磷酸化是调节荷尔蒙分泌的重要因素,并提示靶向PTP-MEG2在分泌过程中的潜在药理学价值。
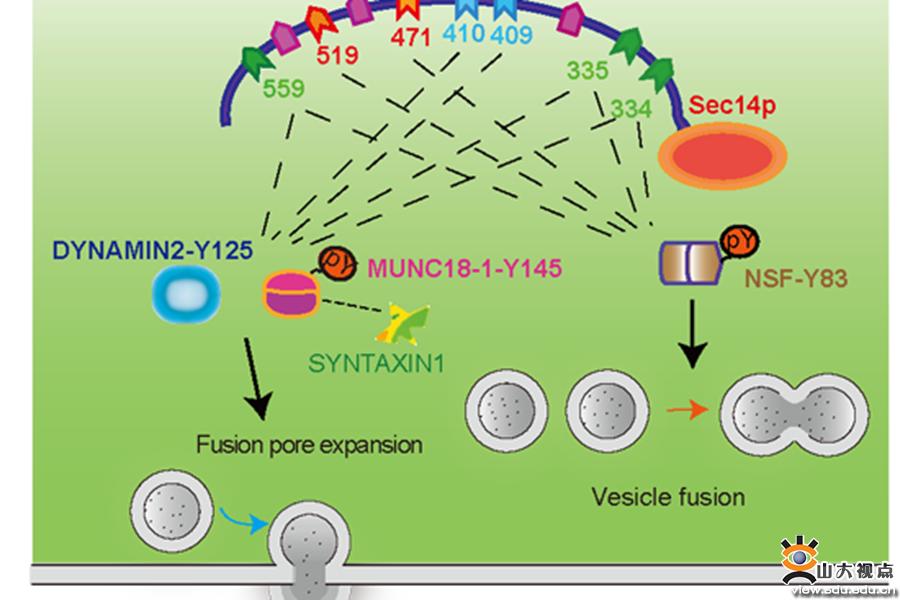
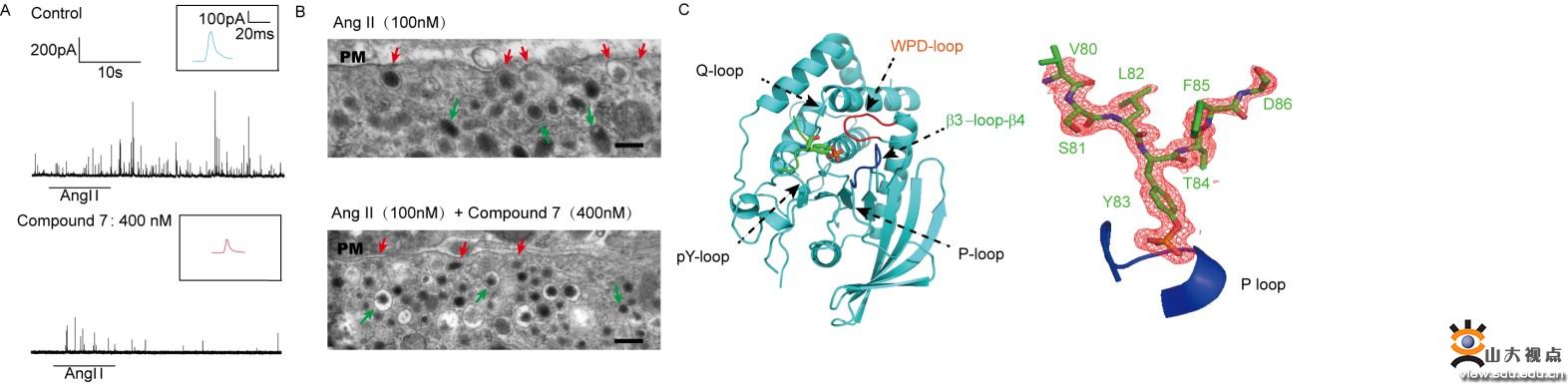
囊泡和细胞膜融合孔的形成和开放一直是囊泡分泌的热点和难点问题。本文中研究人员结合电镜、碳纤电极检测、复合物晶体结构解析等生物物理和电化学方法(下图),首次证明PTP-MEG2通过与两种底物MUNC18-1-pY145和DYNAMIN2-pY125的相互作用来调节胞吐过程中融合孔的初始开放,证明酪氨酸磷酸化在融合孔形成和开放过程中的作用,并揭示了PTP-MEG2介导该过程独特的结构基础,以及PTP-MEG2介导的去磷酸化如何调节融合孔动力学过程。囊泡分泌异常在包括癫痫在内的多种疾病中均有报道,鉴于PTP-MEG2在细胞分泌中有多层次和关键的调节作用,且PTP-MEG2已有特异性的、高度膜渗透性的抑制剂,所以,阐明PTP-MEG2在囊泡融合、释放中的作用有助于加速以PTP-MEG2为靶点的转化医学研究。
该工作还受到普渡大学Zhang Zhongyin教授、厦门大学生物信息学专家纪志梁教授、西安大学电生理专家王昌河教授、中国医科大学囊泡分泌专家赵伟东教授、中国科学技术大学朱中良高级工程师、威尼斯欢乐娱人v3676徐志刚教授的支持与合作。
威尼斯欢乐娱人v3676基础医学院于晓、孙金鹏研究团队关注胰岛和肾上腺代谢生理和病理生理机制研究,在过去的研究中阐明了胰岛环路稳态的代谢平衡调控作用(Nature 2020) (J Clin Invest. 2017)(Diabetologia. 2014)(Diabetologia. 2015),与GPCR相关的通路对胰岛功能的精确调控机制(Br J Pharmacol. 2015),以及粘附类受体对肾上腺稳态的水盐代谢的调控等(Elife. 2018)。上述研究得到了国家自然科学基金项目的资助。
论文链接:http://doi.org/10.15252/embr.202052141