近日,基础医学院马春红教授团队在国际学术期刊Nature communications(中科院一区,IF=17.694)发表了题为“Early life gut microbiota sustains liver-resident natural killer cells maturation via the butyrate-IL-18 axis”的研究成果。威尼斯欢乐娱人v3676基础医学院教授梁晓红、马春红为共同通讯作者,学院博士研究生田盼盼为第一作者,威尼斯欢乐娱人v3676为第一作者单位和唯一通讯作者单位。
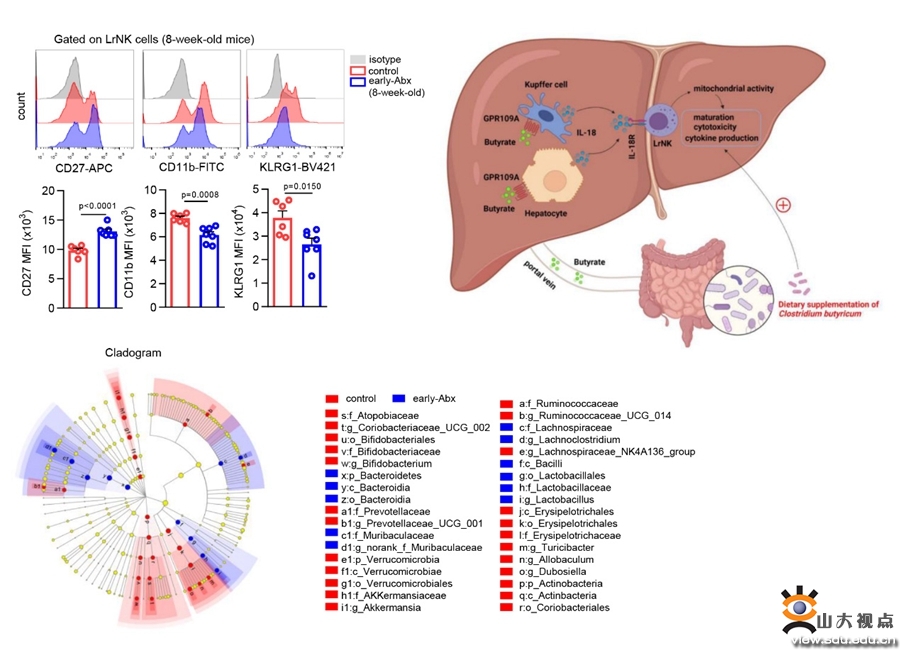
肝脏驻留NK(liver-resident NK, LrNK)细胞是一群在肝脏局部发育和居留的独特的NK细胞,在抗病毒和抗肿瘤免疫调控中发挥重要作用。然而,目前对于LrNK细胞在肝脏内发育成熟的调控机制尚不明确。肝脏和肠道通过门静脉和胆道系统紧密关联,即为“肝—肠”轴,参与维持肝脏区域免疫和功能稳态。生命早期,即围产期、新生儿期和婴幼儿期,是机体肠道菌群发育、定殖的关键时期,决定了成年期肠道菌群组成的多样性和功能的完整性。同时,生命早期也是肠道菌群与宿主免疫相互作用的关键时期。生命早期肠道菌群发育受损(临床最常见的原因为预防性或治疗性抗生素的使用),会造成成年期不可恢复的肠道菌群紊乱进而加重多种免疫疾病的易感性。本研究发现了生命早期抗生素暴露可以抑制成年期小鼠LrNK细胞的成熟、分泌细胞因子的能力以及抗肿瘤功能,揭示了生命早期抗生素暴露导致成年期肠道菌群的组成异常、多样性降低,进而下调肠道和肝脏中菌群代谢产物丁酸的水平,后者作用于肝细胞和Kupffer细胞、调控肝脏微环境内IL-18的水平,最终阻碍了LrNK细胞的成熟和功能,而补充产丁酸菌可以恢复因生命早期抗生素暴露导致的LrNK细胞成熟和功能障碍。该研究首次证实“肠—肝轴”通过影响肝脏细胞互作网络、调控LrNK成熟和功能的重要作用,为阐明生命早期肠道菌群在组织驻留免疫细胞发育中的重要性提供了新的实验依据。
马春红教授团队长期致力于肝脏免疫微环境调控机制的研究,发现了免疫检查点分子Tim-3、PD-1以及NAD+等代谢途径在免疫微环境重塑中的重要作用,为肿瘤免疫治疗提供了潜在靶点和新思路。研究成果发表在J Exp Med,Gut,Hepatology, J Hepatol,Molecular Therapy,Cancer Res,Cell Mol Immunol,Cell Reports等国际权威杂志上。上述研究得到国家重点研发计划、国家自然科学基金重点项目、面上项目及泰山攀登计划等项目的资助。
文章链接:https://doi.org/10.1038/s41467-023-37419-7